
Zmiana klasyfikacji wyrobów medycznych
Kompleksowe dostosowanie i notyfikacja wyrobów medycznych zgodnie z klasyfikacją MDR
Gofarm pomaga wprowadzić nowe produkty na rynek i dostosować istniejące wyroby do nowych regulacji prawnych.

W związku z wejściem w życie nowego rozporządzenia
MDR 2017/745 zmieniają się zasady klasyfikacji wyrobów medycznych. Niektóre pozycje z portfolio mogą wymagać przeprowadzenia procesu dostosowania wyrobu i jego dokumentacji do nowych wymagań.
Procedury, które należy zastosować wymagają czasu- nie zostawiaj tego na później.

Pamiętaj, że wprowadzenie niektórych zmian do dokumentacji wyrobów medycznych to OBOWIĄZEK każdego producenta i dystrybutora.
Czy jesteś gotów na nowe regulacje,
aby utrzymać swoje produkty na rynku?
Przygotuj się na zmiany już dziś!
Nie czekaj na ostatni dzwonek
Masz w swoim portfolio produkty, które wymagają zmian klasyfikacji?
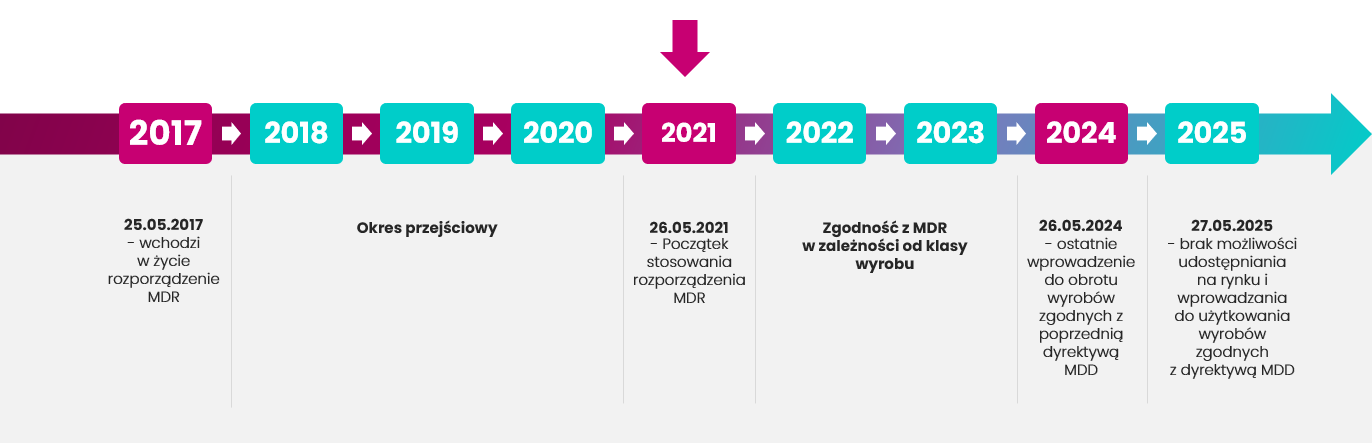
Zapoznaj się z harmonogramem zmian.
Czy wiesz, że…
Gofarm w ciągu 16 miesięcy przeprowadził z sukcesem
ponad 20 zmian klasyfikacji produktów do wyższych klas?
Zaufaj
doświadczeniu i wiedzy ekspertów,
którzy przeprowadzali takie procedury
dla swoich klientów
już wiele razy


CASE STUDY
Producent X ma w swojej ofercie spray do nosa, który jest obecnie wyrobem medycznym w klasie I. Zastanawia się co zrobić, by jego produkt po 26 maja 2024 roku mógł być nadal sprzedawany.
Zgodnie z rozporządzeniem MDR, aby taki wyrób medyczny mógł pozostać w sprzedaży należy dostosować jego dokumentację do nowych wymagań i w wybranych przypadkach zmienić klasę wyrobu z klasy I na wyższą. Nasza firma przeprowadzi audyt dokumentacji wyrobu i doradzi jakie kroki należy podjąć i w jakim terminie, aby zdążyć wprowadzić zmiany na czas. Przeprowadzi Twoją firmę przez cały proces, a Ty zyskasz ciągłość sprzedaży.


Kompleksowe dostosowanie i rejestracja produktów do wyższej klasy produktowej
- Wesprzemy Cię na każdym etapie
- Przeprowadzimy audyt dokumentacji Twoich produktów i zaproponujemy harmonogram wdrożenia zmian/ doradzimy, które wyroby wymagają dostosowania dokumentacji technicznej, certyfikacji, dodatkowych badań
- Szybka i sprawna aktualizacja dokumentacji
- Zaoszczędzisz czas
- Rzetelna, merytoryczna pomoc ze strony zespołu Gofarm
- Propozycja jednostki notyfikowanej
- Przeprowadzimy Twoją firmę przez cały proces, a Ty zyskasz ciągłość sprzedaży swoich wyrobów medycznych
Uwaga!
Proces dostosowania wyrobów medycznych do zasad MDR wymaga czasu i czasami udziału jednostek notyfikowanych.
Weź to pod uwagę planując wdrożenie zmian.
Pomożemy Ci
W/w usługi prowadzone są w oparciu o następujące podstawy prawne: Rozporządzenie Parlamentu Europejskiego i Rady (UE) 2017/745 z dnia 5 kwietnia 2017 r. w sprawie wyrobów medycznych, zmianą dyrektywy 2001/83/WE, rozporządzeniem (WE) nr 178/2002 i rozporządzeniem (WE) nr 1223/2009 oraz uchyleniem dyrektyw Rady 90/385/EWG i 93/42/EWG


