
Dostosowanie do MDR
Czy jesteś gotowy na nowe regulacje,
aby utrzymać swoje wyroby medyczne na rynku?
Wiemy, że dostosowanie wyrobów medycznych do nowych regulacji prawnych wymaga czasu,
zasobów oraz specjalistycznej wiedzy,
dlatego proponujemy wsparcie dla Twojej firmy w procesie zmian.
Zaufaj doświadczeniu Gofarm i powierz pracę nad swoim produktem naszym specjalistom.
Zyskasz pewność, że wszystko odbędzie się sprawnie,
zgodnie z harmonogramem oraz aktualnymi regulacjami.
Czy jesteś gotów na nowe regulacje,
aby utrzymać swoje produkty na rynku?
Przygotuj się na zmiany już dziś!
Nie czekaj na ostatni dzwonek
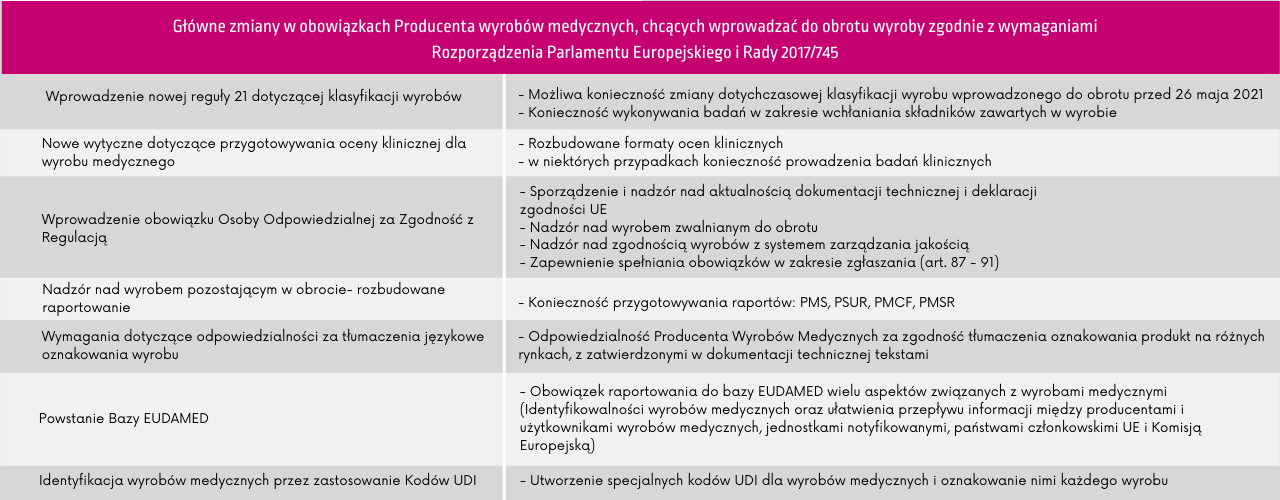

Pamiętaj, że wprowadzenie niektórych zmian do dokumentacji wyrobów medycznych to OBOWIĄZEK każdego producenta i dystrybutora.

Dostosowanie wyrobów medycznych zgodnie z nowymi zasadami MDR
- Opracowywanie dokumentacji technicznej wyrobów według wymagań MDR dla wszystkich klas wyrobów
- Opiniowanie istniejących dokumentacji pod kątem spełniania wymagań zmieniających się przepisów prawnych, w tym oceny klinicznej
- Pomoc w wyborze jednostki notyfikowanej
- Opracowanie planów obserwacji klinicznej po wprowadzeniu do obrotu (PMFC = Post-market clinical follow-up)
- Przygotowanie podsumowania dotyczącego bezpieczeństwa i skuteczności klinicznej (SSCP = Summary of safety and clinical performance)
- Opracowywanie/aktualizacja planu nadzoru po wprowadzeniu wyrobu do obrotu (PMS = Post-market surveillance plan)
- Prowadzenie nadzoru nad dokumentami po wprowadzeniu do obrotu
- Opracowywanie/aktualizacja okresowych raportów o bezpieczeństwie (PSUR = Periodic Safety Update Report) oraz raportu po wprowadzeniu do obrotu (PMSR = Post-market surveillance report)
- Zapewnienie osoby odpowiedzialnej za zgodność z regulacjami prawnymi
- Wsparcie na każdym etapie zmian
Uwaga!
Proces dostosowania wyrobów medycznych zgodnie z MDR wymaga czasu i często udziału jednostek notyfikowanych.
Weź to pod uwagę planując wdrożenie zmian.
Pomożemy Ci
W/w usługi prowadzone są w oparciu o następujące podstawy prawne: Rozporządzenie Parlamentu Europejskiego i Rady (UE) 2017/745 z dnia 5 kwietnia 2017 r. w sprawie wyrobów medycznych, zmianą dyrektywy 2001/83/WE, rozporządzeniem (WE) nr 178/2002 i rozporządzeniem (WE) nr 1223/2009 oraz uchyleniem dyrektyw Rady 90/385/EWG i 93/42/EWG.


