
NEWS – Wydłużenie okresów przejściowych dla wyrobów medycznych w Dzienniku Urzędowym UE
Dzisiaj (20.03.2023 r.) opublikowano w Dzienniku Urzędowym Unii Europejskiej rozporządzenie zmieniające MDR, dotyczące wydłużenia okresów przejściowych dla wyrobów medycznych z certyfikatami. Zmiany weszły w życie zaraz po publikacji i już obowiązują.
Co się zmienia?
Certyfikaty wydane przez jednostki notyfikowane ważne w dniu 26 maja 2021 r., których nie wycofano po tym terminie,, pozostają ważne po zakończeniu okresu wskazanego w certyfikacie do:
- 31.12 2027 r. – w przypadku wyrobów klasy III i IIb do implantacji,
- 31.12.2028 r. – w przypadku wyrobów klasy IIb, IIa i klasy Is i Im.
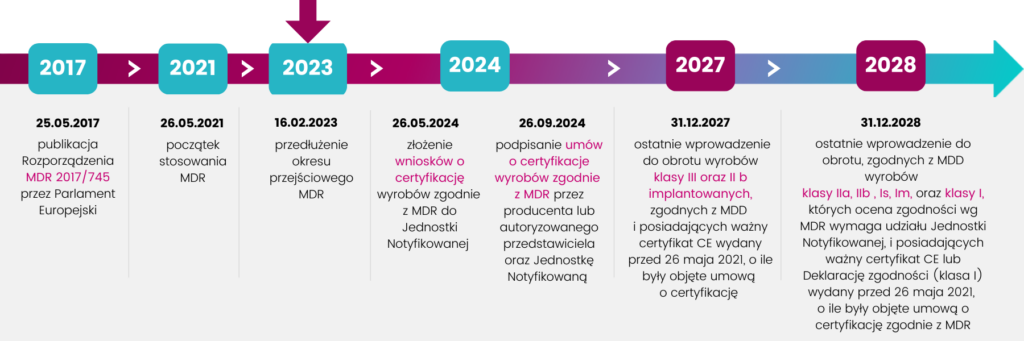
Natomiast wyroby klasy I wg MDD, które zgodnie z MDR powinny być zaklasyfikowane do klasy wyższej, mogą być wprowadzane do obrotu do 31.12.2028 r. jednakże pod pewnymi warunkami:
- są nadal zgodne z MDD,
- nie wprowadzono istotnych zmian,
- nie stwarzają ryzyka dla bezpieczeństwa i zdrowia użytkowników oraz pacjentów,
- producent wyrobu wprowadzi system zarządzania jakością zgodny z MDR nie później niż 26.05.2024 r.
- producent lub upoważniony przedstawiciel nie później niż do dnia 26.05.2024 r., złoży formalny wniosek do jednostki notyfikowanej dot. certyfikacji wyrobu, a także nie później niż do dnia 26.09.2024 r. podpisze umowę z jednostką notyfikowaną dot. certyfikacji wyrobu.
Usunięcie klauzuli sell-off
Zrezygnowano z daty końcowej (klauzula sell-off), dzięki czemu wyroby medyczne wprowadzone do obrotu przed początkiem obowiązywania MDR mogą być nadal udostępniane na rynku i wprowadzane do używania bez terminu końcowego.
Nowe regulacje prawne wprowadzają sporo zmian do branży wyrobów medycznych.
Chcesz wiedzieć więcej o MDR 2017/745? Potrzebujesz pomocy ekspertów w dostosowaniu swoich wyrobów medycznych do nowych regulacji prawnych?
Chcesz wiedzieć więcej?
Poznaj naszą serię „Bądź gotowy na MDR” i przeczytaj poprzednie artykuły.





