
Producencie wyrobów medycznych – pamiętaj o ważnych terminach w 2024 roku!
Obecny rok jest niezwykle ważny dla producentów i dystrybutorów wyrobów medycznych. Zgodnie z przyjętymi przez Komisje Europejską zmianami w treści MDR 2017/745, okresy przejściowe dla wyrobów medycznych uległy wydłużeniu (decyzja opublikowana w Dzienniku Urzędowym UE dnia 20.30.2023 r.). Jednak, aby z nich skorzystać, należy spełnić określone warunki i zadbać o zachowanie wyznaczonych terminów.
Wydłużone okresy przejściowe dla wyrobów medycznych
Certyfikaty wydane przez jednostki notyfikowane ważne w dniu 26 maja 2021 r. (których nie wycofano po tym terminie), pozostają ważne również po zakończeniu okresu wskazanego w certyfikacie:
- w przypadku wyrobów klasy IIa, IIb i klasy Is i Im – do 31.12.2028 r.
- w przypadku wyrobów medycznych klasy III i IIb do implantacji – do 31.12.2027 r.
Natomiast wyroby należące wg Dyrektywy 93/42 EWG (MDD) do klasy I, które zgodnie z nowymi przepisami powinny być zaklasyfikowane do klasy wyższej, mogą być wprowadzane do obrotu do 31.12.2028 r. pod wskazanymi niżej warunkami:
- są nadal zgodne z MDD,
- nie wprowadzono istotnych zmian,
- nie stwarzają ryzyka dla bezpieczeństwa i zdrowia użytkowników oraz pacjentów,
- producent wyrobu wprowadzi system zarządzania jakością zgodny z MDR nie później niż 26.05.2024 r.
- producent lub upoważniony przedstawiciel nie później niż do dnia 26.05.2024 r., złoży formalny wniosek do jednostki notyfikowanej dot. certyfikacji wyrobu, a także nie później niż do dnia 26.09.2024 r. podpisze umowę z jednostką notyfikowaną dot. certyfikacji wyrobu.
Ważne terminy
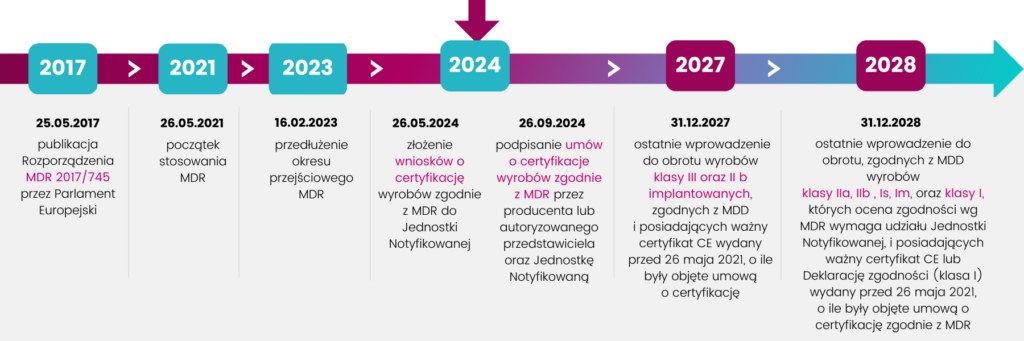
Okresy przejściowe – ważne daty! Aby skorzystać z okresów przejściowych kluczowe w tym roku są dwie daty:
26 maja oraz 26 września 2024 r.
Do 26 maja 2024 należy złożyć do wybranej jednostki notyfikowanej wniosek o certyfikację wyrobów zgodnie z MDR.
Do 26 września 2024 należy podpisać z jednostką notyfikowaną umowę o certyfikację wyrobów zgodnie z MDR.
Harmonogram wdrożenia MDR 2017/745 pokazuje poniższy wykres:
Co jeśli nie zdążysz?
Jeśli w Twoim portfolio produktowym znajdują się wyroby medyczne, których nie możesz certyfikować wg nowych regulacji (np. z powodu składu lub wskazań), skontaktuj się z nami.
Wyroby medyczne Gofarm dostępne w modelu Private Label to gotowe do sprzedaży produkty, które czekają na Twoją markę. My zadbamy o zapewnienie zgodności wyrobów z wymaganiami prawnymi, abyś Ty mógł szybko i skutecznie wprowadzić je do sprzedaży.
Wybierz ten produkt, który najlepiej pasuje do Twojego portfolio i wprowadź go na rynek szybko i skutecznie.
Chcesz wiedzieć więcej o nowych regulacjach dotyczących wyrobów medycznych? Potrzebujesz pomocy ekspertów w dostosowaniu swoich wyrobów medycznych? Chcesz wprowadzić do swojego portfolio nowe, ciekawe, gotowe produkty?
Chcesz wiedzieć więcej?
Poznaj naszą serię „Bądź gotowy na MDR” i przeczytaj poprzednie artykuły.





